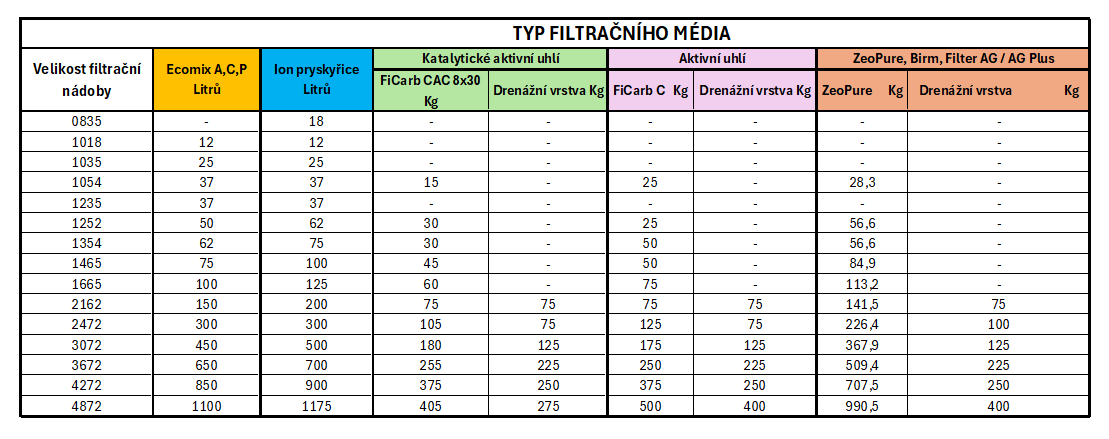
Pomůcka pro správné plnění filtračních nádob Připravili jsme pro vás praktickou pracovní pomůcku, která vám usnadní správné dávkování filtračních materiálů a ionoměničových pryskyřic do kompozitních filtračních nádob pro úpravu pitné i procesní vody...
Novinky, Strana 2
Výpis článků
💧 Rychlost odpařování vody z bazénu Odpařování vody z bazénu závisí na teplotě vody a vzduchu, relativní vlhkosti a rychlosti větru. Rychlost větru se vztahuje ke skutečné rychlosti na hladině vody, která bývá nižší než běžná venkovní rychlost kvůli...
Existuje několik základních chemických parametrů, které by měl každý majitel bazénu pravidelně testovat a sledovat pomocí kvalitních testovacích zařízení jako jsou proužky, nebo fotometr. Základní sledované parametry: FCl – Volný chlór ...
V této stručné informaci vám vysvětlíme, proč, když jsou všechny hodnoty bazénové vody v pořádku tak voda není čistá, nebo začnou růst řasy. Vysvětlíme co je hlavní příčinou a co je kyselina kyanurová – stabilizátor chloru – a proč může být zároveň u...
HTH Chlorové tyčinky 300g - nestabilizovaný chlor s vysokou koncentrací Chlorové tyčinky HTH jsou anorganické chlorové tablety bez stabilizátoru, které jsou určeny k dezinfekci bazénové vody. Tato tyčinka účinně bojuje proti bakteriím, virům, fungic...
Parametry aktivního uhlí z různých surovin se liší svými vlastnostmi, což ovlivňuje jejich vhodnost pro různé aplikace. 1.) Velikost částic - je deklarovaná distribuce velikosti částic, která nepřekračuje maximální zrnitost o více než 15%...
Chlorid hořečnatý hexahydrát je látka používaná ke zvýšení celkové tvrdosti (GH) vody díky přítomnosti iontů hořčíku (Mg²⁺). Nemá žádný vliv na karbonátovou tvrdost (KH) ani na koncentraci hydrogenuhličitanů (HCO₃⁻) nebo karbonátů (CO₃²⁻). P...
Hydrogenuhličitan draselný je látka používaná ke zvýšení karbonátové tvrdosti (KH) a stabilizaci pH vody. Působí podobně jako hydrogenuhličitan sodný, ale místo sodíku (Na⁺) přidává ionty draslíku (K⁺), což může být výhodné v některých aplikacích. ...
Hydrogenuhličitan sodný, známý také jako jedlá soda, je látka používaná ke zvýšení karbonátové tvrdosti (KH) a stabilizaci pH ve vodě. Působí primárně díky hydrogenuhličitanovým iontům (HCO₃⁻), které přímo přidává do vody. Parametr Hodnota ...
Uhličitan vápenatý je běžná látka používaná ke zvýšení celkové tvrdosti (GH) a karbonátové tvrdosti (KH). Při přítomnosti oxidu uhličitého (CO₂) může nepřímo přispět ke zvýšení koncentrace hydrogenuhličitanů (HCO₃⁻). Parametr Hodnota při dá...